Découvertes IPS
Un système de distribution « peptidique »

Photo : Crédit photo: Pr. Victor Jeffrey Leyton
Combien d'entre vous êtes habitués que vos commandes effectuées en ligne soient livrées dès le lendemain à votre porte? Ne serait-il pas extraordinaire qu’il en soit de même à l’échelle cellulaire pour la distribution de molécules impliquées dans le traitement de certains cancers ? Malheureusement, malgré une évolution rapide des découvertes en matière de molécules, la livraison de celles-ci en est encore à ses premiers balbutiements. En effet, si l’on devait situer la « livraison intracellulaire » sur une ligne du temps, on serait transportés à l'époque des carrioles où un colis prenait des mois à être livré, voire pouvait même souvent ne jamais arriver à destination. Cela étant dit, qu’il s’agisse d’une paire de chaussures commandée par Internet ou d’une molécule médicamenteuse administrée à un patient atteint du cancer, l’importance de l’efficacité du transporteur est à ne jamais négliger. Qu’est-ce qui fait qu’une thérapie contre le cancer est en mesure d’atteindre le noyau des cellules cancéreuses en quantité suffisante pour exercer son plein effet thérapeutique? C’est exactement à ce système de « transporteurs » internes que s’est intéressé Alexis Rioux-Chevalier, étudiant au baccalauréat en génie chimique et biotechnologique, dans le cadre de son stage avec Victor Jeffrey Leyton, professeur-chercheur à la Faculté de médecine et des sciences de la santé (FMSS) et au Centre de recherche du CHUS (CRCHUS), de même que membre de l’Institut de pharmacologie de Sherbrooke (IPS). Petit voyage à bord d’un peptide 5 étoiles signé Leyton & Rioux-Chevalier.
Peu peuvent attribuer à la pandémie leurs réussites ou leurs bons coups, mais le duo de scientifiques Leyton & Rioux-Chevalier peut à tout le moins se vanter d’avoir retiré un maximum de résultats d’une circonstance qui, au départ, leur aura occasionné quelques maux de tête. En effet, alors que son stage de l’hiver 2020 devait se dérouler en présentiel dans les laboratoires de l’IPS, Alexis Rioux-Chevalier a dû, avec l’aide du professeur Victor Jeffrey Leyton, redesigner complètement son expérience. Le stage offert par le laboratoire Leyton, qui avait pour cible deux obstacles rencontrés dans le transport d’une molécule anticorps utilisée dans le traitement de certains cancers, devait se faire sur place avec les infrastructures de haute technologie disponibles à l’IPS. L’objectif global de cette recherche était d’améliorer la performance du camion de livraison (peptide) dont le rôle est d’amener la molécule anticorps à bon port (à l’intérieur du noyau de la cellule). Ne reculant devant rien, le jeune bachelier a travaillé d’arrache-pied pour que ses travaux puissent être effectués via un logiciel de chimio-informatique spécialisé plutôt que directement en laboratoire. Ce passage obligé aura finalement permis au jeune stagiaire de développer un algorithme qui a propulsé la recherche vers de nouveaux cieux jusqu’alors inexplorés.
Rester positif : pas toujours une solution
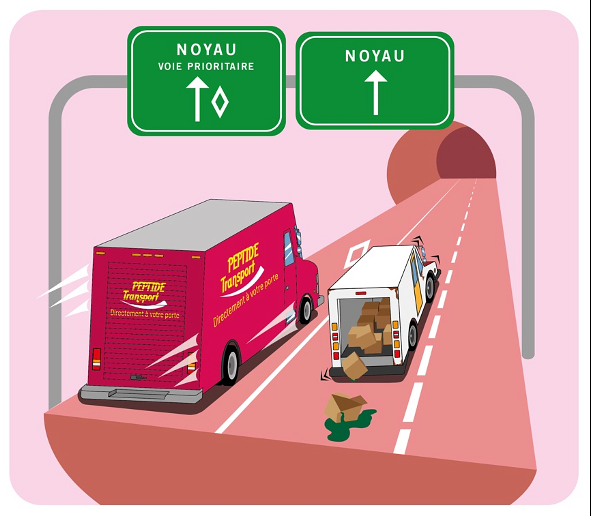
Photo : Crédit photo: Christian Audet, graphiste
À l’échelle microscopique, le corps humain se comporte un peu comme une batterie. Certains éléments sont chargés positivement, alors que d’autres ont une charge négative. Ce sont les interactions entre ces mêmes charges qui permettent à plusieurs réactions électrochimiques de se produire dans nos corps à chaque jour afin que nos cellules puissent fonctionner de manière optimale. Ces dernières, habituellement chargées négativement, attirent donc naturellement à elles les éléments chargés positivement dans leur environnement, comme les protéines et les peptides. Cet effet d’attraction devient fort intéressant pour les scientifiques qui travaillent sur des médicaments qui ont pour cible le noyau de la cellule. En effet, une stratégie populaire consiste à attacher la molécule (médicament) à des peptides (camions) qui se lieront ensuite aux protéines (douaniers) qui permettent l’accès au-delà de la frontière du noyau. Toutefois, le problème avec les thérapies plus ciblées comme les chimiothérapies, c’est que puisque les séquences d’acides aminés (NLS : Nuclear Localization Sequence) agissant comme “transporteurs” sont chargées positivement, elles se lient non seulement aux cellules cancéreuses, mais aussi aux cellules saines qui ont la même charge. L’efficacité de la thérapie s’en trouve donc réduite, une quantité insuffisante de médicament se retrouvant à l’intérieur des cellules cancéreuses. Afin de contrer cette lacune, il est donc apparu nécessaire de développer des peptides neutres pour permettre à une plus grande quantité du médicament de se rendre à la cible.
Neutraliser grâce à Python
Savoir d’où proviennent les lacunes est une chose, mais comment réussir à créer ces peptides neutres qui optimiseraient la livraison du médicament à la tumeur? C’est précisément le défi auquel a été confronté l’étudiant Alexis Rioux-Chevalier dans son mandat de stage. Les peptides, qui sont en réalité une suite plutôt longue d’acides aminés (comme une sorte de chaîne), présentent autant de combinaisons possibles que celles offertes par les loteries populaires. Même pour le chercheur le plus aguerri, tester chacune de ces combinaisons in vitro pourrait prendre des mois, voire des années.
En raison des contraintes de la pandémie, les deux scientifiques ont décidé de regarder la problématique d’un point de vue plus statistique, grâce au logiciel de chimio informatique. Avec l’aide du Pr. Leyton, Alexis Rioux-Chevalier a donc commencé à travailler sur une formule (algorithme) qui pourrait potentiellement leur permettre d’effectuer cette présélection de candidats « neutraliseurs de charge » en un claquement de doigts, sans avoir à tester chacune des combinaisons. C’est à ce moment de l’histoire que l’algorithme élaboré par le jeune scientifique intervient : sommairement, ce calcul complexe (élaboré grâce au langage de programmation Python) identifie, sur la chaîne du peptide NLS, les acides aminés modifiables qui ont pour effet de neutraliser la charge du peptide sans toutefois altérer sa capacité de liaison avec les protéines cellulaires assurant le transport vers le noyau. Brillamment conçu par le stagiaire, cette formule se base sur la force de liaison entre le peptide (camion) et les protéines intracellulaires (douaniers). Grâce à cet algorithme, il a été possible d’identifier plusieurs combinaisons potentiellement efficaces pour améliorer le transport du médicament au noyau, puis d’en rejeter plusieurs qui n’occasionnaient pas de changements significatifs permettant d’améliorer la performance du transporteur.
Une découverte qui pourrait en engendrer d’autres
Les candidats qui ont été repérés grâce à la découverte d’Alexis Rioux-Chevalier sont présentement évalués in vitro dans le laboratoire du Pr. Leyton, tout cela dans le but de déterminer les séquences les plus efficaces et de les localiser dans le noyau cellulaire. Une fois la combinaison gagnante trouvée, le professeur et son équipe pourront entrer dans une phase préclinique, c’est-à-dire qu’ils pourront tester le candidat le plus performant directement dans des tissus vivants (in vivo) afin de valider sa véritable efficacité dans un milieu se rapprochant du corps humain. La découverte de ce candidat et son application clinique pourraient améliorer la thérapie anti-cancer visée par la recherche et avoir un impact important dans cette lutte ardue contre le cancer.